《科学》:特异性清除病理性tau蛋白的阿尔茨海默病疗法出现了

《科学》重磅:特异性清除病理性tau蛋白的阿尔茨海默病疗法出现了!
可溶性生理性蛋白的病理性聚集是许多常见神经退行性疾病的基础病理变化,tau蛋白和阿尔茨海默病(AD)就是一个很典型的例子。此前,《自然·神经科学》杂志上的一项研究也揭示了tau蛋白调节神经胶质细胞脂滴形成,抵抗活性氧损伤的神经保护机制。因此,去除病理性聚集tau,保留生理性tau,对于AD的治疗是很重要的。
正在进行临床试验的反义寡核苷酸(ASO)药物就是可以减少tau蛋白积累的药物,但是ASO会减少总蛋白库,生理性蛋白的丢失不可避免,可能会造成潜在影响,而其他类型的药物,例如直接针对tau的蛋白质水解靶向嵌合体和细胞内表达的基于抗体的tau降解剂,要么是非选择性的,要么必须依赖于靶向结合的特异性以产生聚集体选择性。
因此,目前,我们需要强效且有选择性的消除蛋白质聚集体的方法。
在今天的《科学》杂志上,剑桥大学英国痴呆症研究所的研究团队发表最新研究成果,他们开发了一种靶向细胞内蛋白质聚集体,同时保留蛋白质单体的策略,即利用E3泛素连接酶TRIM21的聚集体依赖性激活,将它的RING结构域与tau靶向特异性纳米抗体融合,在体外和小鼠模型中,通过腺相关病毒载体递送,有效减少了tau病理[1]。
TRIM蛋白家族属于E3泛素连接酶,具有三元结构域,包括RING结构域、B-box结构域和coiled-coil结构域,其中RING结构域赋予了E3连接酶活性,使TRIM蛋白能够泛素化靶蛋白,导致靶蛋白被降解或改变亚细胞定位或功能。
基于此,TRIM21和胞质抗体受体能够介导抗体结合靶点的破坏,包括病毒、细胞蛋白和tau聚集体。此前的研究已经发现,TRIM21是抗tau免疫治疗所必需的,具有播种能力的tau聚集体能够将抗体引入胞质,激活TRIM21,中和结合的聚集体[2]。
在本研究中研究人员尝试将TRIM21的RING结构域融合到抗tau蛋白C端特异性纳米抗体F8-2的变体,组成了能够在胞质中表达的tau聚集体降解剂R-NbF8-2。
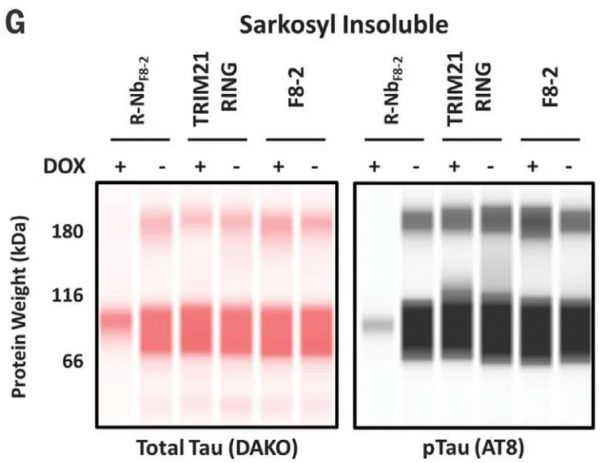
在体外实验中,研究人员仅在表达R-NbF8-2的细胞中观察到不溶的总tau和磷酸化tau减少,他们还发现,R-NbF8-2表达后,可溶性tau也有部分减少,但这些tau有一个明显较高的分子量条带,并且能够被磷酸化tau抗体识别,这表明它们可能是小的磷酸化聚集体。
仅有表达R-NbF8-2的细胞中观察到不溶性tau减少大脑相对其他组织和器官,对药物递送更加严苛,因此,研究人员在体内实验的第一步先验证了R-NbF8-2降解大脑中蛋白的能力。

他们使用腺相关病毒1/2(AAV1/2)作为载体搭载R-Nb,单侧注射到2月龄小鼠的海马中,在注射后10天,相比对侧海马,注射侧海马中由绿色荧光蛋白标记的易被TRIM21介导降解的低聚组蛋白2B的降解已经发生。这证实了基于AAV的中枢神经系统递送是可行的,以及递送后R-Nb确实能够介导低聚蛋白的降解。
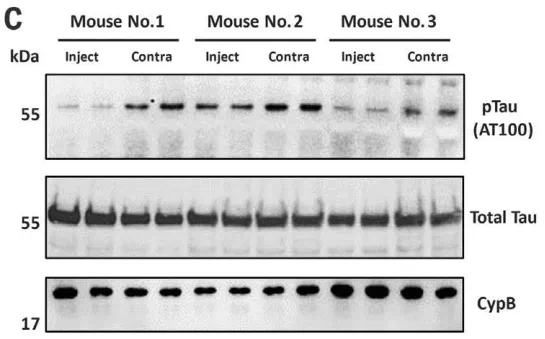
在这个良好的开端下,研究人员构建了表达人0N4R P1301S tau的老龄Tg2541小鼠,将搭载R-NbF8-2的AAV1/2载体单侧注射到小鼠的额叶皮层,这些小鼠大脑中存在大量的AT8阳性tau病理,10天后,注射一侧的磷酸化tau显著减少,而总tau未受影响。
注射一侧(Inject)磷酸化tau显著减少,总tau无变化,不但如此,R-NbF8-2还以剂量依赖的方式减少了神经元中种子tau的聚集,单独含有TRIM21 RING结构域或F802的AAV1/2载体则没有这种影响。
为了在临床应用中有效,可能需要在大量受tau病理影响的大脑细胞中表达R-Nb,想要在小鼠中实现这一点,研究人员想到了工程化AAV衣壳AAV9P31,能够在外周静脉注射后转导至大脑。他们选择了短期(10天)和长期(2个月)两种实验方案。
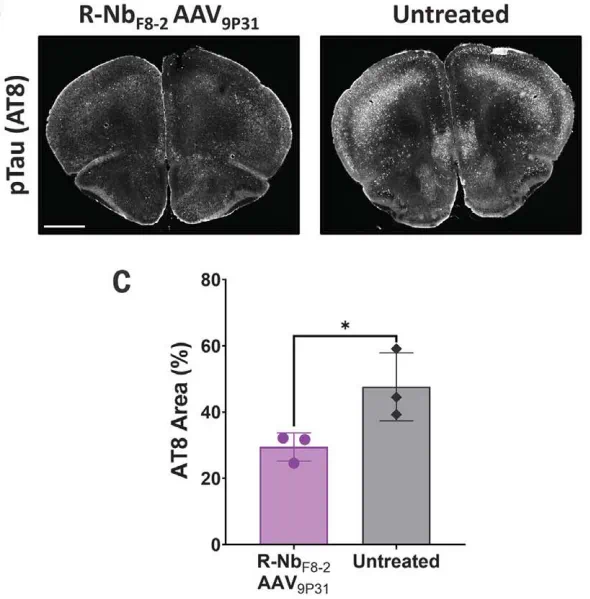
短期方案中,5.5月龄具有严重tau病理的Tg2541小鼠接受了10天的R-NbF8-2 AAV9P31治疗,治疗组小鼠相比对照组,额叶皮层和脊髓的磷酸化tau病理减少,总tau没有变化。
治疗组小鼠的额叶皮层中磷酸化tau减少
长期方案中,4月龄具有中度tau病理的Tg2541小鼠接受了2个月的R-NbF8-2 AAV9P31治疗,研究人员同样观察到了治疗组小鼠磷酸化tau和不溶性总tau显著减少,可溶性总tau也有不显著的减少,后者的原因有待确定。另外,治疗组小鼠大脑中具有播种能力的tau也显著减少。
综上所述,这项研究提供了一种特异性降解病理性tau聚集体,同时很大程度保护生理性可溶性tau单体的治疗方法。未来的进一步研究将探索tau聚集体选择性清除的功能影响和长期毒性分析,为R-Nb作为神经退行性疾病中tau蛋白,以及其他病理性聚集蛋白的治疗方法的可行性提供更多的信息。